Programme d’enseignement
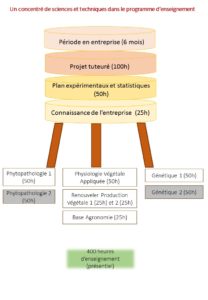
SCHÉMAS GÉNÉRAL
DÉTAILS DES MODULES
Premier semestre
Obligatoires
HLBI521 Génétique et sélection végétale 1
Présentation
Dans une première partie, ce module se propose de donner une culture générale autour de l’amélioration des plantes. Une analyse historique de l’amélioration des plantes est réalisée afin d’amorcer une réflexion autour de l’évolution de la vitesse du progrès génétique, des idéotypes et aussi du métier de sélectionneur.
Dans une seconde partie, les différentes méthodologies pour améliorer les germplasms et pour créer sont décrites. Les schémas utilisés classiquement utilisés en sélection tels que les backcross, les sélections récurrentes, les sélections généalogiques et les tests diallèles sont décrits en détail. Une partie du cours est aussi utilisée pour donner des outils permettant de raisonner / suivre ces schémas de sélection (ex, calculs d’AGC/ASC, calculs d’héritabilité, statistiques d’évaluation d’un génotype,…). Ces cours théoriques sont aussi illustrer par des cours réalisés par différents acteurs de l’amélioration des plantes.
Exemple d’interventions :
- Guy Clément (retraité CFR/CIRAD) : cours sur la sélection du riz en Camargues
- Simon Vanderlinden (Rijk Zwaan) : cours sur sélection de la tomate
- Frederic Bakry (CIRAD) : cours sur la sélection du bananier
- André Clement-Demange (CIRAD) : cours sur la sélection de l’hévéa
- Vincent Gensollen (GEVES) : visite du GEVES Montpellier
L’expérimentation en sélection conservatrice est abordée dans une troisième partie du cours. Les différentes méthodes de production de semences et les différentes manières d’améliorer la production et la qualité des semences sont traitées grâce à l’intervention de professionnels.
Exemples d’interventions :
- Sophie Colénot (Monsanto) expérience en production de semence
- Olivier Leblanc ( IRD) différents aspects de l’expérimentation sur les semences
- David Martinez (Clause Hm) expérimentation en qualité des semenceS
En plus des cours, les étudiants doivent présenter un exposé dans lequel ils doivent élaborer un programme de sélection sur une espèce cultivée. Pour préparer cette exposé, l’étudiant doit mettre en pratique ce qu’il a vu en cours et aussi avoir des echanges avec des sélectionneurs.
Objectifs
- Acquérir les bases de génétique et d’amélioration des plantes pour démarrer une activité d’assistant sélectionneur.
- Acquérir les connaissances pour faire de l’expérimentation en production de semences.
- Acquérir une culture générale sur l’amélioration des plantes.
- Savoir analyser un article scientifique.
ECTS :5
Organisation :
- CM 30h
- TD 19,5h
Contrôle de connaissance
- Oral 30%
- Ecrit 70%
Mots clé :amélioration des plantes, schémas de sélection, idéotype, production semences
HLBI522 Physiologie Végétale Appliquée
Présentation
Ce module a pour but d’expliquer/ justifier les différentes pratiques culturales en fonction des connaissances acquises en physiologie végétale.
- Les semences (qualité, traitement, conservation, production, semis…)
- Développement végétatif (nutrition, photosynthèse, cas des serres, densité de semis, taille,…)
- La floraison et fécondation (besoins climatiques, autostérilité, éclaircissage…)
- Développement du fruit (besoins nutritionnels, traitement hormonaux, éthylène,…)
- Résistance des plantes aux stress abiotiques (irrigation, paillage, génétique,…)
Des travaux pratiques illustrent plusieurs aspects des cours /TD
- Comprendre les semences : Mesure d’activité amylase chez l’orge et le blé
- Comprendre la photosynthèse : Mise en évidence des différentes composantes de la photosynthèse par des expérimentations simples.
- Comprendre le développement : Phénotypage de quelques mutants d’Arabidopsis
Objectifs
- Acquérir les bases de connaissances pour comprendre la nutrition des plantes
- Acquérir les bases de connaissances pour comprendre les différentes étapes du développement des plantes
- Comprendre la physiologie des semences
ECTS :5
Organisation :
- CM 21
- TD 19,5
- TP 9
Contrôle de connaissance
- TP 30%
- Ecrit 70%
Mots clé :nutrition, développement, semence, mutants, physiologie
HLBI523 Bases Agronomie
Présentation.
Une série de conférence fait principalement par des professionnels permet de réviser les bases de l’agronomie et d’approfondir certains aspects.
Exemples d’interventions :
- Thierry Simmoneau (INRA)
- Richard Brand (GEVES)
Ces cours sont complétés par un travail personnel sur la culture d’une espèce. Ce travail est présenté lors d’un exposé.
Objectifs
- Revoir les bases d’agronomie normalement acquises après un DUT, un BTS ou un BTSA.
- Approfondir certains aspects de la modification des itinéraires culturaux.
- Savoir réaliser un exposé.
ECTS :2,5
Organisation :
- CM 9
- TD 15
Contrôle de connaissance
- Oral 30%
- Ecrit 70%
Mots clé :agronomie, céréales, légumineuses, rendement, itinéraire cultural
HLBI524 Connaissance entreprise
Présentation
Ce module a pour objectif de donner quelques outils d’insertions au sein d’une entreprise. Il est organisé en :
- Cours magistraux / TP
- Franc-Christophe BAURENS (CIRAD) – Les règles de sécurité (serre-laboratoire)
- Ludovic MARIN (UM- staps) – Les postures au travail CM et portage de charge lourde (TP en Gymnase)
- Visite d’entreprises.Les visites d’entreprises sont divisées en deux parties.
- Exercice d’embauche. 15 jours avant la visite, les étudiants reçoivent une offre d’emploi envoyée par l’entreprise. Les étudiants ont une semaine pour y répondre (CV+lettre de motivation). Le jour de la visite un debriefing sur les CV et les lettres de motivation est effectué par un membre de l’entreprise en charge du recrutement. Le meilleur candidat est auditionné pour en entretien d’embauche devant ses camarades.
- Visite des installations.
Les entreprises visitées sont :
- Monsanto(Nimes). Exemple d’une entreprise semencière. De la création variétale à la distribution des semences.
- Staphyt(Marsillargues). Exemple d’une entreprise d’expérimentation végétale. Description du déroulement d’un essai de A à Z. Discussion sur les métiers de technicien/chef d’expérimentation.
- CTIFL(Balladran). Exemple d’un centre technique. Descriptions des activités du centre technique et visite des expérimentations menées dans les serres.
- CIRAD(Montpellier). Visite des serres et descriptions des expérimentations qui y sont menées.
Objectifs :
- Connaître les filières « semence » et « phytosanitaire », les centres d’expérimentations et de recherche en France et dans les pays Tropicaux
- Connaître les différents services d’une entreprise.
- Notions de sécurité au travail (posture, étiquettes,…)
- Savoir faire un CV, une lettre de motivation et réaliser un entretien d’embauche
ECTS :2,5
Organisation :
- CM 9h
- TER 16h
Contrôle de connaissanceCC 100%
Mots clé :entreprise, CV, lettre de motivation, posture, sécurité
HLBI525 Phytopathologie 1
Présentation
Sous forme de cours Magistraux , TD et travaux pratiques, les étudiants vont explorer différents aspects des expérimentations en phytopathologie :
- Connaitre les différents organismes phytopathogènes (virus, viroides, phytoplasmes, bactéries, champignons, nématodes, insectes, adventices)
- Connaître le fonctionnement des microorganismes phytopathogènes.
- Connaître les mécanismes de défenses des plantes aux microorganismes phytopathogènes
- Connaitre les mécanismes de contournement des microorganismes phytopathogènes aux gènes de résistances et produits phytosanitaires.
- Acquérir des notions en épidémiologie.
De nombreux chercheurs du CIRAD, de l’INRA, de l’IRD et de supagro participent à ce module.
Lors des TP, une expérimentation en pathologie est mise en place (culture du pathogène, culture des plantes, inoculation, lecture des symptômes, dénombrement pathogène, activité catalase)
Objectifs
- Connaitre les bases de l’interaction plante / microorganisme pour mener à bien des expérimentations de :
- Sélection de plantes résistantes,
- d’efficacité de produit phyto ou de biocontrôle,
- de compréhension des mécanismes importants dans l’interaction
- Savoir mener une expérimentation en phytopathologie
ECTS :5
Organisation :
- CM 21h
- TD 19,5h
- TP 9h
Contrôle de connaissance
- TP 30%,
- Ecrit 70%
Mots clé :virus, bactérie, champignon, nématode, virulence, effecteur
HLMA507 Plan d’expérimentation – Statistiques
HLMA507 Plan d’expérimentation – Statistiques
Présentation
Ce module se décline en cours magistraux dans lesquels sont présentés les différents systèmes expérimentaux (RCB, bloc de Fisher, carré latin, split-plot, criss-cross, blocs éclatés,….) ainsi que les différents tests statistiques et leurs conditions d’utilisation. Ces cours sont mis en pratique grâce à des travaux dirigés où les étudiants doivent faire des tests statistiques , en utilisant le logiciel R, sur des cas concrets.
Objectifs
- être capable de faire un plan expérimental.
- connaître les tests les plus classiques et leurs conditions d’application.
- Savoir manipuler le logiciel R
ECTS :5
Organisation :
- CM 19,5h
- TD 30h
Contrôle de connaissance
- CC 30%
- Ecrit 70%
Mots clé :ANOVA, plan d’expérimentation, test statistique, modèle linéaire
Option (1 parmi 2)
HLBI526 Génétique et sélection végétale 2
Présentation
Ce module commence par une mise à niveau en biologie moléculaire. Ensuite les cours présentent l’impact des biotechnologies sur le progrès génétique. Enfin une description des différentes biotechnologies utiles en amélioration des plantes est réalisée. Ces biotechnologies sont classées en deux groupes : (i) celles qui permettent decréer ou propager des mutationsintéressantes (mutagenèse, polyploïdisation, haplodiplométhodes, culturein vitro, transgénèse, édition du génome, …) et (ii) celles qui favorisentla recombinaisondes mutations (croisements interspécifiques, hybridation somatique, marquage moléculaire, …). Ces cours sont illustrés par des interventions réalisées par des professionnels.
Exemples de cours réalisés par des professionnels :
- Frederic BAKRY (CIRAD) Biotechnologies du bananier
- Carole CONSTANT (SAKATA) : Visite de SAKATA
- Leslie GADAL (Monsanto) Biotechnologies chez Monsanto
- Michel ROMESTANT (RAGT) : Rôle d’un laboratoire de marquage moléculaire
9h de travaux pratiques de cultures cellulairesin vitro(culture cellulaire tabac, pomme de terre, carotte,…) et de biologie moléculaire (criblage transformant génétique)
Objectifs
- Acquérir les bases des biotechnologies auxquelles peut être confronté un technicien dans une entreprise semencière et en tant qu’assistant sélectionneur.
- Acquérir une culture générale sur les biotechnologies végétales.
- Savoir manipuler en condition d’aseptie.
- Savoir réaliser et interpréter une PCR.
ECTS :5
Organisation :
- CM 21h,
- TD 19,5h
- TP 9h
Contrôle de connaissance
- TP 30%,
- Ecrit 70%
Mots clé :Marquage moléculaire, transgénèse, édition génome, culture in vitro
HLBI512 Biotechnologies
Présentation
L’enseignement en module de biotechnologie se décline en Cours Magistraux, Travaux Dirigés et travaux Pratiques.
Cours magistraux (21 h).Les cours Magistraux s’intéresseront aux biotechnologies basées sur le clonage (multiplication à l’identique d’un génotype intéressant) ou sur l’ADN recombinant (transgenèse), appliquées à des organismes différents : microorganismes, plantes, animaux et homme.
– Biotechnologies des microorganismes (6 h)– Jean-Luc Aymeric : Production de microorganismes d’intérêt (Bacillus thuringensis, levure de fermentation, Bactéries stimulant la croissance des plantes,…), Création/Utilisation de microorganismes pour la production de molécules d’intérêt (aspartame, insuline, antibiotiques,…)
–Biotechnologies des plantes (6h)– Lien Bach : culturein vitro( micropropagation, embryogenèse somatique, haploidisation, sauvetage d’embryon, cryoconservation, culture cellulaire,…) et OGM (transgenèse et hybridation somatique)
–Biotechnologies de l’Homme et des animaux (6h)– Soazig Guyomarc’h : thérapie cellulaire et génique, correction des problèmes d’infertilité, clonage animal, transgenèse animale
–Culture générale sur les biotechnologies (3h)– Fabrice Varoquaux :définition des biotechnologies, description et caractéristiques des entreprises de biotechnologie, création d’entreprise.
Travaux dirigés(19,5 h)(Soazig Guyomarc’h, Mathieu Ingouff, Jean-Luc Aymeric, Liên Bach). Les TD auront 4 thématiques principales :
– Approfondissement de techniques vu en cours (clonage moléculaires, clonage cellulaire, transgenèse) (9h)
– Préparation à l’examen final (annales d’examen) (3h)
– Préparation à la rédaction du compte rendu de Travaux Pratiques (1,5h)
– TD débat autour de la problématique des Organismes Génétiquement Modifiés (6h)
Travaux Pratiques(9 h)(Mathieu Ingouff, Liên Bach)
– Illustration des biotechnologies végétales: différents aspects de la culturein vitro(tabac, arabidopsis, carotte, persil, pomme de terre, chou-fleur, ananas) et sur la réalisation d’OGM (criblage antibiotique, PCR, …)
– Illustration des biotechnologies des microorganismes :fabrication de bière.
Objectifs
Les compétences à acquérir :
- des connaissances sur les différentes applications du clonage dans le cas de l’Homme, des animaux, des microorganismes et des plantes
- des connaissances sur les applications des technologies de l’ADN recombinant dans le cas de l’Homme, des animaux, des microorganismes et des plantes.
- un esprit critique sur la problématique des OGM
- Les bases de la manipulation sous hotte à flux laminaire (culturein vitrovégétale)
ECTS : 5
Organisation :
- CM : 21
- TD : 19.5
- TP : 9
Contrôle de connaissance
- CC 15%
- TP 15%
- Ecrit 70%
Mots clé :Clonage, ADN recombinant, Végétal, Animal, Microorganismes
Second semestre
Obligatoires
HLBI612 Renouveler la Production Végétale1
Présentation
Cours magistraux (6 h) (Fabrice Varoquaux)
–Dans un premier temps, et en prenant l’exemple du blé, nous étudierons lesbases scientifiquessur lesquelles est basée l’agriculture intensive.
–Dans un second tempsnous réaliserons une analyse detype risques/bénéfices de l’agriculture intensive. Cette partie se conclu par une liste de propositions pour faire évoluer l’agriculture dans une démarched’agro-écologie. Certaines d’entre-elles seront travaillées lors des travaux dirigés.
Travaux dirigés (12 h)(Laurence Marquès, Fabrice Varoquaux + divers intervenants du secteur public ou privé)
Dans les travaux dirigés, différentes pistes scientifiques pour faire évoluer l’agriculture sont suivies :
–Cultiver autre chose(ex : + diversité,…)
–Cultiver autrement(ex : usage des microorganismes, Bio-pesticides, intensification écologique…)
–Cultiver ailleurs(ex exploitation sol contaminé (phytoexclusion),…)
– « Licenciales » :
Par petit groupe, vous devrez réaliser un projet de création d’entreprise innovante autour du thème de « Renouveler la Production Agricole » . Votre présentation de projet d’entreprise sera réalisé devant un public mixte enseignants/ entrepreneurs.
Visited’entreprise(3 h)(Laurence Marquès, Fabrice Varoquaux)
Le site visité varie d’une année en fonction des souhaits des étudiants et de la disponibilité des entreprises. Exemple de visites effectuées dans le cadre de ce module : Monsanto, Vilmorin, Geves, CTIFL,…
HLBI636 Renouveler la Production Végétale 2
Présentation
Ce module a pour objectif de présenter des expérimentations sur des itinéraires culturaux alternatifs à l’agriculture intensive classique. Les cours sont réalisés par des enseignants chercheurs de l’université de Montpellier ainsi que quelques chercheurs du privé.
- Les Plantes dans l’espace – Fabrice Varoquaux (3 heures)
- Pour limiter les problèmes d’irrigation : faire des plantes résistantes à la sécheresse – Olivier Rodrigues (3 heures)
- Agroforesterie – Christian Jay-Allemand (3 heures)
- La découverte d’un stimulateur des défenses naturelles : le Stifénia – Jean-Claude Baccou (1,5 heures)
- Cultiver les algues – Jean-Claude Baccou (1,5 heures)
- Cultiver les plantes pour des molécules d’intérêt – Christian Jay-Allemand (3 heures)
- Les Outils d’aide à la décision – Damien Fumey (ITK) (3 heures)
- Les engrais organiques – Benjamin Ourliac (Fertinagro) (3 heures)
- Visite du site d’agroforesterie de Restinclière – Christian Jay-Allemand.
Objectif
- Avoir une culture générale sur les modes alternatifs à l’agriculture intensive traditionnelle
- Avoir des bases dans des experimentations en agro-écologie
ECTS :2,5
Organisation :
- TD 15h
- TP 10h
Contrôle de connaissance
- TP 30%
- Ecrit 70%
Mots clé :Agroforesterie, algue, OAD, irrigation, engrais
HLBI634 Projet tuteuré
Présentation
Dans ce module, les étudiants en groupe de 3 ou 4, travaillent sur un projet concret, proposé par des enseignants chercheurs ou des chercheurs d’entreprises privées, et ainsi mettent en pratique des connaissances théoriques. Le projet se déroule en deux étapes.
La première étape est réalisée au premier semestre. Elle consiste à préparer une expérimentation au niveau scientifique, statistique, technique et financier. Ce travail sera jalonné tout au long du premier semestre grâce à la réalisation de plusieurs oraux de types « séminaires de laboratoire » autour de plusieurs thématiques :
- Séminaire 1 : Recherche bibliographique autour de leur thématique de projet tuteuré.
- Séminaire 2 : Journal club, avec une analyse fine d’un article clé autour de leur thématique de projet tuteuré
- Séminaire 3 : Présentation du plan expérimental et traitement statistiques des données
- Séminaire 4 : Présentation des besoins matériels liés à leur expérimentation.
La seconde étape est réalisée au second semestre où l’expérimentation sera mise en place, suivie et analysée. Le planning du second semestre est adapté afin de libérer du temps pour le suivi régulier de l’expérimentation qui peut se faire dans des laboratoires de recherche tels que ceux de l’UMR AGAP du CIRAD ou dans une serre (Bat65) de l’université. Ce travail de projet tuteuré fait l’objet d’un rapport de 10 pages en anglais.
Exemples de projets :
- Influence du calendrier lunaire sur la germination d’Arabidopsis thaliana(2015/2016)
- Analyse l’effet d’une inoculation parPhyllobacterium brassicacearumSTM196 sur la réponse de 15 variétés de riz à un stress salin (2015/2016)
- Effet deBurkholderia vietnamensissur la croissance du riz en condition d’hydroponie (2015/2016)
- Influence de l’intensité et le spectre lumineux sur la germination de la stévia (2016/2017)
- Effet d’une inoculation parGlomus intraradiceset d’une inoculation parrhizobium pisi, isolée ou cumulée, sur la croissance du pois (2016/2017)
- Influence du calendrier lunaire sur la croissance du radis, de la carotte, de la laitue, du pois et de la capucine (2015/2016)
Objectifs
- Etre capable de faire une analyse bibliographique (NCBI pubmed, agricola,…)
- Etre capable de lire et d’analyser un article scientifique
- Mettre en pratique les cours de statistique
- Savoir tenir un cahier de manipulations, organiser ses données numériques
- Travailler les présentations scientifiques sous forme de séminaire
- Travailler l’anglais technique et scientifique.
ECTS :5
Contrôle de connaissance
CC 100%
Mots clé :expérimentation, séminaire, rapport, cahier de manipulation
HLBI635 Stage
Présentation
La formation licence Pro EVAPPMT prévoit un stage de longue durée (5mois) : de début avril à fin aout. Ce stage peut avoir lieu dans des entreprises privés ou des laboratoires publics, en France ou à l’étranger.
Exemples d’entreprise/ laboratoire accueillant des stagiaires :
- Expérimentation végétale :Agrolis consulting, AgroXP, Staphyt, …
- Centre techniques :CEHM, CEFEL, CTIFL, IFV…
- Entreprises biostimulant/biocontrôle :Elephant vert,…
- Entreprise semencière :CFR, Monsanto, Technisem, Vilmorin, …
- Laboratoire public :AGAP (Cirad/inra), BPMP (CNRS/INRA),…
- Laboratoire privé: ADN-ID, Algosud,…
Objectifs
- Mettre en pratique des cours au service d’une thématique appliquée
- Acquérir une expérience professionnelle.
- Apprendre à rédiger un rapport
ECTS : 15
Contrôle de connaissance
- Rapport de stage de 20 pages :coef 1
- Oral 20 minutes :coef 1
- Réponse au question 10 minutes :coef 1
Option (1 parmi 2)
HLBI637 Phytopathologie 2
Présentation
Durant ce module, sont explorées les différences et similarités entre les interactions bénéfiques et interactions pathogènes. Une partie importante du cours est consacrée à la compréhension des mécanismes impliqués dans les interactions bénéfiques (mycorhizes, bactéries symbiotiques, PGPR,…) et de leur potentiel pour l’amélioration des pratiques agricoles. Une autre partie importante du cours concerne les réglementation autour de l’homologation et aussi des expérimentations autour des biostimulants et des produits de biocontrôle.
Exemples d’intervenants extérieurs :
- Karine GROSBEAU (Eléphant vert) : Réglementations autour des biostimulants / produits de biocontrole
- Sabine GALINDO (Polytech) : les mycotoxines
Deux visites
- Visite Lallemand Plant Care : la production d’inoculum bacterien
- Visite de Staphyt : essaie de produit de bio-control, BPE, BPL et CEB
Un TPdans lequel les étudiants ont 3 séances pour mener une expérimentation permettant de tester l’effet d’une PGPR sur :
- L’augmentation de la croissance du riz dans des conditions optimales
- L’augmentation de la croissance du riz dans des conditions limitantes en intrants
- L’augmentation de la croissance du riz dans un terreau stérile
- L’augmentation de la croissance du riz dans des conditions de stress salins,…
Les étudiants doivent phénotyper les plantes de même que faire des dosages biochimiques (sucre, azote, chlorophylle,…), des activités enzymatiques (catalase, nitrate reductase,…)
Réalisation d’une vidéo.Les etudiants doivent réaliser une vidéo de 5 minutes sur un microorganisme pathogène ou bénéfique.
Objectifs
- Avoir les connaissances de base sur les microorganismes bénéfiques afin de povoir mener une expérimentation en Biostimulation / biocontrôle.
- Connaitre les règles pour l’expérimentation sur les produits de bio-contrôle (stimulation)
- Connaitre les règles d’homologation des produits de bio-contrôle (stimulation)
- Avoir pratiqué l’expérimentation en produit de biocontrôle
- Savoir faire une vidéo
- Savoir faire un dosage biochimique, une activité enzymatique.
ECTS :5
Organisation :
- CM 21h
- TD 19,5h
- TP 9h
Contrôle de connaissance
- TP 30%
- Ecrit 70%
Mots clé :PGPR, symbiose, mycorhize, réglementation, BPE, BPL, CEB, bio-contrôle, bio-stimulation.